タンパク質研究を行うにあたっては、研究目的とするサンプルの分子量分布と構造を知ることが重要です。 従来のGPC(SEC)法を用いた場合、分子量が溶出容量に従って単純に減少していくと仮定しているので、構造を決定するのは不可能です。 その結果、構造が分離の開始点から終了点まで一定であるように見えてしまいます。 このアプリケーションノートは、液体クロマトグラフに多角度光散乱検出器(DAWNまたはmini DAWN)を接続することによって、タンパク質の構造や構造の変化をどのように決定することができるかを明らかにします。
図1は、眼球中に存在するタンパク質である精製されたα-クリスタリンをSEC分離したものです。 従来、UVピークの高分子側に見られるショルダーはメインピークに含まれるものよりもさらに広がった構造の物質で構成されていると考えられていましたが、これを確認する方法はありませんでした。 今回、10mWのアルゴンレーザーを備えたDAWN DSPを用いて、これらのピーク全体の絶対分子量分布を決定したところ、分子量と溶出容量のプロットの顕著な非直線性から、ショルダーが本当に異なった構造であることが明らかになりました。 さらに、UVで検出される高分子側に尾を引く部分について、溶出容量が小さくなると分子量の勾配が大きくなるという観察結果から密度の高い構造であることが確認されました。
図2が示すように、ASTRAソフトウェアを使用し分子量対回転半径をプロットすると、高分子側に伸びているショルダー部分について、タンパク質の構造を決定することが可能です。 二つの異なった勾配を持つスロープが認められますが、スロープの急勾配から密度の高い分子と言うよりも拡張された構造の分子構造であることが容易に説明できます。 α-クリステリンについて、ショルダー部分が実際拡張された構造をもった分子を含んでいることを確認することができました。
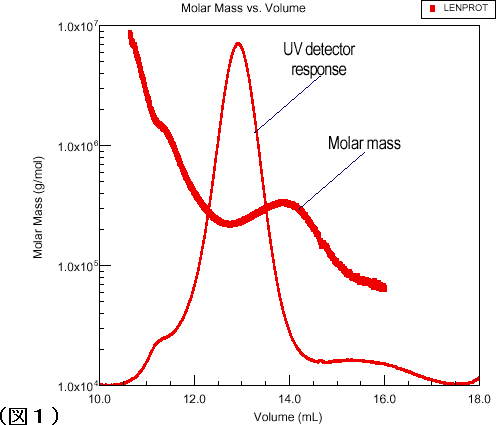
図1:UVの応答は特に異常を示しませんが、分子量と溶出容量の関係において顕著な変化が認められます。
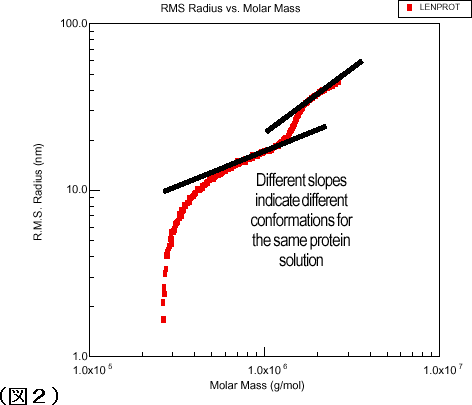
図2:UV検出器のショルダーの部分のスロープの違いからタンパク質分子に異なった構造が存在することを確認できます。