タンパク質の大きさや分子量を正確に測定することにより、球状タンパク質と繊維状タンパク質などの形状の違いや、大きなタンパク質を形成するサブユニットに関する情報を得ることが出来る。 また、免疫複合体や酵素とその阻害タンパク質などのタンパク質同士の会合状態に関する情報を得ることが可能である。タンパク質などの生体高分子の分子量測定には浸透圧、光散乱、沈降平衡などを利用した方法が知られている。 また、簡便な方法として電気泳動やHPLCが用いられているが、いずれの方法も信頼性、簡便性などの面で一長一短である。
今回、多角度光散乱検出器MultiangleLaserLight ScatteringDetector(MALS)をHPLC装置に接続して、タンパク質の分子量に関する情報を簡便且つ正確に測定することが可能となったので報告する。
| Sample | : | Bovine serum albumin, BSA(Sigma) α1 Acid glycoprotein(Sigma) Lysozyme(Seikagaku Kogyo Co., Ltd.) |
| Pump | : | Shodex DS-4 |
| Column | : | Shodex PROTEIN KW-803(Silica-based) |
| Eluent | : | 0.05M Sodium phosphate buffer + 0.15M NaCl pH7.4 |
| Flow rate | : | 1.0mL/min |
| Detector | : | Wyatt DAWN DSP-F, Shodex RI |
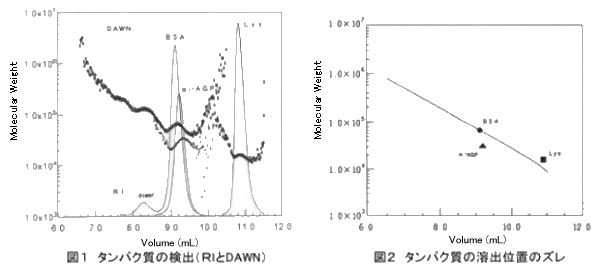
図1は溶出してきたタンパク質をRIとDAWNで検出したクロマトグラムである。 また図2はこれらの結果を縦軸にDAWNにより求めた分子量、横軸にKW-803からの溶出容量をとってブロットし、分子量マーカーなどに用いられる標準タンパク質を測定して得られた較正曲線と比較したものである。 BSAのDAWNから得られた分子量は、この測定条件での溶出容量と較正曲線を比較して推定される分子量とほぼ一致(約60kDa)した。 一方塩基性タンパク質であるLysはシリカ系の基材上に存在するシラノール基との相互作用の結果、実際よりも遅れて溶出し、較正曲線に照らしたときの見かけの分子量は小さくなる。
また、α1-AGPのような酸性タンパク質はシラノール基との反発が起こり、その溶出は本来の位置よりも早まり、見かけの分子量は大きめになる。 このように末知のタンパク質の分子量を、HPLCを用いてGFCモードで測定する際にはその表面電荷によっては実際の分子量と異なる位置に溶出することがある。 しかしDAWNを併用することにより誤差の少ない情報を得ることが可能であり、しかもタンパク質の電気的性質などに関するヒントを得ることも可能である。 さらにBSAは一部がdimerとなっていることが知られているが、図1に示されるように実際のクロマトグラムのDAWNから得られる分子量からもタンパク質の二量体化が示唆される。
今回は分子量についてのデータをもとに話を進めたが、MALSを用いることにより、タンパク質、多糖類、核酸のような天然あるいは生体高分子の分子量のみならず、その大きさも簡便かつ非破壊的に測定することが可能となる。 いわば生きたままこれらの生理活性物質の姿に迫ることが可能となるわけで、2種類以上の高分子の相互作用などの解明に威力を発揮していくものと思われる。